Діль Катерина Володимирівна
аспірант кафедри фізичної, органічної та неорганічної хімії
Дніпровського національного університету імені Олеся Гончара
м.Дніпро
Анотація: дана стаття присвячена можливому способу отримання низькомолекулярного хітозана з різних доз ферментних препаратів папаїна та протосубтиліна. Показано, що для отримання низькомолекулярного хітозану потрібно вибирати залежно від вида ферменту. Для отримання даного полімеру слід продовжувати гідратацію 6 годин при дозі фермента не більше 1%.
Ключові слова: хітозан, хітин, біологічно-активні речовини, низькомолекулярний хітозан.
Вступ.
Хітозна - найвідоміше і вивчене похідне хітину. Цей полімер є продуктом часткового або повного диацетилювання хітину і являє собою полі- (1-4) -2-аміно-2-дезокси-β-D-глюкозу.
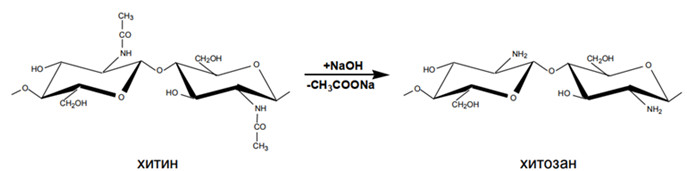
На сьогоднішній день відомі три основні способи отримання низькомолекулярного хітозана: хімічний, фізичний, ферментативний. Найбільш популярним є ферментативний спосіб, який полягає в збереженні вихідної природної структури хітозана [1, 2, 3].
Низькомолекулярні хітозани володіють більш високою біологічною активністю порівнюючи з високомолекулчрними [4, 5]. В якості ферментних препаратів для деградації хітина та хітозана застосовують комплекси ферментів різного походження.
Дослідженнями хітозану займаються в 15 країнах і в даний час відомо більше 70 напрямків практичного застосування хітину та хітозану., а також їх модифікацій, найбільш важливими з яких визнані біотехнологія та екологія, харчова промисловість, медицина, косметика, сільське господарство та ветеринарія. [1, 2].
Мета: вивчення впливу вида та дози ферментних препаратів на фізико-хімічні показники хітозана.
Задачі:
- Вивчення оранолептичних показників хітозана;
- Дослідження фізико-хімічних показників хітозана;
- Гідрування хітозана різними ферментними препаратами;
- Встановлення зміни молекулярної маси в процесі гідрування різними дозами ферментних препаратів;
Матеріали та методи дослідження.
- Ферментний гідроліз високомолекулярного хітозана був проведений за допомогою протеалітичних рідких ферментних препаратів: папаїна, протосубліна.
- Вихідний хітин був отриманий з панциря річкового рака деміниралізацією кислоти, депротинируванням рідких ферментних препаратів, отриманих з шлунку тканин риби, з наступною лужною очисткою від залишків білкових речовин.
Результати дослідження та обговорення.
В результаті гідрування хітина концентрованим розчином луга (50%-м) отриманий хітозан має молекулярну масу 172 кДа, ступінь деацелювання – 77% при вмісті, %: води-5,8; нітратних сполук-0,92; мінеральних речовин-0,22. Такий хітозан є високомолекулярним і не може мати широкого застосування.
Таблиця 1
Органолептичні та фізико-хімічні показники хітозана.
|
Показники |
Органолептичні показники |
Фізико-хімічні показники |
|
Колір |
кремовий |
|
|
Запах |
Без запаху |
|
|
Розміри частинок, мм |
|
2,5 |
|
Густина, кг/м3 |
|
0,2 |
|
Вміст, % -води: |
|
5,8 |
|
-нітратних речовин (N·6,25): |
|
0,92 |
|
-мінеральних речовин: |
|
0,22 |
|
Молекулярна маса, кДа |
|
172 |
|
Ступінь деацитилювання, % |
|
77 |
|
Розчинність в оцтовій кислоті, % |
|
91,8 |
|
В’язкість 1% розчину в оцтовій кислоті, мм2/с |
|
3,9 |
Щоб отримання низькомолекулярного полімера з високомолекулярного хітозана потрібно приготувати 1%-й розчин з використанням 0,2 М ацетатного буфера, рН якого становить 5,0. До отриманого розчину внести папаїн та протосубтилін дозами 1, 2, 3% відповідно. Нагрівати при температурі 520С протягом 8 годин. В процесі гідрування через кожну годину визначати молекулярну масу і в’язкість 1% розчина сирноподібного осаду в оцтовій кислоті.
Рисунок 1
Технологічна схема отримання низькомолекулярного хітозана

Визначення органолептичних і фізико-хімічних властивостей є дуже важливим для характеристики хітозана. Ступінь депротинірування та демінарилізації виявляє такі фізико-хімічні характеристики хітозана, як в’язкість і розчинність.
Таблиця 2
Зміна молекулярної маси хітозана в процесі гідрування ферментними препаратами
|
Час, год |
Доза ферментних препаратів, % |
|||||
|
1,0 |
2,0 |
3,0 |
||||
|
Молекулярна маса, кДа |
||||||
|
Попаїн |
Протосубтилін |
Попаїн |
Протосубтилін |
Попаїн |
Протосубтилін |
|
|
0 |
172 |
172 |
172 |
172 |
172 |
172 |
|
1 |
131 |
158 |
120 |
138 |
82 |
108 |
|
2 |
110 |
121 |
105 |
112 |
73 |
91 |
|
3 |
90 |
103 |
88 |
93 |
49 |
76 |
|
4 |
83 |
90 |
67 |
82 |
37 |
56 |
|
5 |
66,5 |
86 |
45 |
60 |
19,5 |
44 |
|
6 |
64 |
83 |
43 |
58 |
19,5 |
31 |
|
7 |
64 |
83 |
43 |
58 |
1,5 |
31 |
|
8 |
64 |
83 |
43 |
58 |
19,5 |
31 |
Виходячи з даних таблиці 2 гідрування вихідного хітозана з молекулярною масою 172 кДа молекулярна маса зменшується в залежності від дози фермента продовження самого процесу гідрування. Виявлено, що ферментний препарат папаїн більш ефективний в процесі гідрування хітозана. Через 5 годин гідрозування хітозана папаїном при дозі 1, 2, 3% його молекулярна маса зменшується до 66,5; 45,0 і 19,5 кДа відповдно. Протосубтилін в тих же дозах зменшує молекулярну масу хітозана за вказаним часом гідрування до 86,0; 60,0; 44,0 кДа відповідно.
Після 6 годин гідрування продовження процесу до 8 годин не змінюється молекулчрна маса, незважаючи від виду препарату і його дози. Виключення складає доза папаїна 3%, який спричинює уменшення молекулярної маси до 19,5 кДа протягом 5 годин гідрування.
Висновки.
Таким чином, було досліджено:
- Встановлена можливість получити низькомолекулярного хітозана з застосуванням різних доз ферментних препаратів папаїна та протосубтиліна.
- Виявлено, що дозу ферментного препарату для того щоб отримати низькомолекулярного хітозана необхідно вибирати в залежності від виду фермента та призначення полімера для застосування. Для отримання полімер з молекулярною масою нижче 100 кДа достатня тривалість гідрування 6 годин при дозі ферментів не більше 1%; при збільшенні дози ферментів до 2% можливо отримати полімер з молекулярною масою 45-60кДа за вказаний час гідрірування; отриманий полімер з молекулярною масою менше 20 кДа можливе за 5 годин гідрування при дозі папаїна 3%.
Література
1. Lim S. H., Hudson S. M. Application of a fiber-reactive chitosan derivative lo cotton fabric as an antimicrobial textile finish // Carbohydr. – Polym. – 2004. – Vol. 56. – P. 227–234.
2. Получение многофункционального низкомолекулярного хитозана и его применение в косметике / С. Б. Сео, Ч. С. Рго, Х. Б. Ким и др. // Косметическая химия. – 2003. – № 1. – С. 26–30.
3. Purification and characterization of chitosanase from Bacillus sp. strain KCTC 0377BP and its application for the production of chitosan oligosaccharides / Y. I. Choi, E. J. Kim, Z. Piao et al. // Appl. Environ. Microbiology. – 2004. – Vol. 70, N 8. – P. 4522–4531.
4. Rhoades J., Roller S. Anlimicrobial actions of degraded and native chitosan against spoilage organisms in laboratory media and foods // Appl. Environ. Microbiol. – 2000. – Vol. 66, N 1. – P. 80–86.
5. Kittur F. S., Kumar A. B.V., Tharanalhan R. N. Low molecular weight chitosans – preparation by depolymerization with Aspergillus ttiger pectinase, and characterization // Carhohydr. Res. – 2003. – Vol. 338. –P. 1283–1

